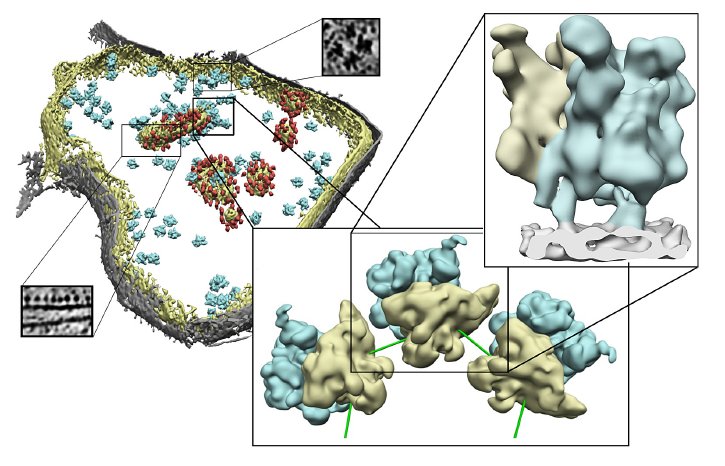
Mitochondrien sind essentielle Bestandteile unserer Zellen. Sie dienen als eine Art Kraftwerk, die alle Lebensprozesse mit der notwendigen Energie versorgen. Die Reaktionszentren der Mitochondrien sind wahre Wunderwerke an Effizienz: Während die meisten vom Menschen gebauten Motoren lediglich 20 bis 30 Prozent der Energie umsetzen, die sie verbrauchen, erreichen die Reaktionszentren in den Mitochondrien Wirkungsgrade von über 90 Prozent. Diese komplexen Reaktionszentren bestehen aus einer Vielzahl von Einzelteilen, deren wichtigste Bestandteile von den hochspezialisierten Ribosomen der Mitochondrien synthetisiert werden. Während die cytosolischen Ribosomen frei durch das Innere der Zelle schweben, sitzen die Mito-Ribosomen fest verbunden auf den Membranen der Mitochondrien und können so neu gebildete Proteine direkt in die Reaktionszentren einbauen.
Wissenschaftlern der Zellbiologie der TU Kaiserslautern und der Forschungsgruppe "Modellierung von Proteinkomplexen" des Max-Planck-Instituts in Martinsried bei München gelang es jetzt erstmals, die Struktur des Mito-Ribosoms in seiner natürlichen Umgebung sichtbar zu machen. Möglich wurde dies durch die Verwendung der Kryo-Elektronentomographie und neuartigen Einzelelektronen-Detektoren. Dieses innovative Verfahren erlaubt vorher unvorstellbare Einblicke in die Struktur unserer Zellen. Professor Johannes Herrmann, der die Abteilung für Zellbiologie in Kaiserslautern leitet, erklärt das so: "Während man früher mit Elektronenmikroskopen nur hauchdünne metallbedampfte Schnitte untersuchen konnte, können wir jetzt Zellen wie in einem Eiswürfel im Elektronenmikroskop hin- und herdrehen und dabei alles in seiner dreidimensionalen Struktur sehen, und das noch mit unglaublich hoher Auflösung".
Mit diesem Verfahren entdeckte das bayerisch-pfälzische Forscherteam zwei Verbindungsstützen, durch die die Mito-Ribosomen direkt mit der Membran verbunden sind. Durch biochemische Experimente konnten sie herausfinden, dass eine dieser Stützen durch das Membranprotein Mba1 gebildet wird. "Ein alter Bekannter, wir hatten dieses Protein schon 2006 als einen Rezeptor identifiziert, der Mito-Ribosomen mit der Membran verbindet. Aber jetzt sehen wir zum ersten Mal, wie Mba1 dies genau macht und erkennen dabei, dass es quasi als molekulare Rutschbahn die neu synthetisierten Proteine in die Membran einführt" schwärmt Herrmann. Die Forscher wollen ihre begonnene Zusammenarbeit in Zukunft noch weiter verstärken, um die Details der Architektur mitochondrialer Ribosomen aufzuklären und ihre molekulare Funktionsweise bei der Bildung der Reaktionszentren zu verstehen.
Originalveröffentlichung:
Pfeffer, S., Woellhaf, M.W., Herrmann, J.M., Förster, F.: Organization of the mitochondrial translation machinery studied in situ by cryo-electron tomography. Nature Commun, January 22, 2015, Doi: 10.1038/ncomms7019
Link: www.nature.com/...