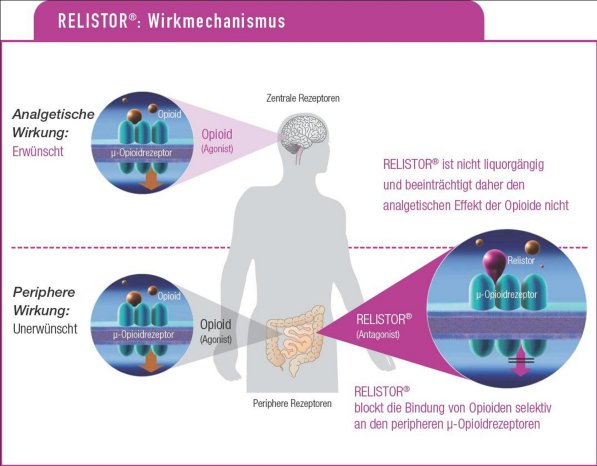
Der periphere -Opioid-Rezeptor-Antagonist Methylnaltrexon (Relistor®)ist der erste in Europa zugelassene Vertreter eines neuen Wirkprinzips zur kausalen Therapie der Opioid-induzierten Obstipation. Der Wirkstoff hemmt selektiv die Bindung der Opioid-Rezeptoren im Darm kompetitiv. "Das quartäre Derivat des Morphin-Antagonisten Naltrexon zeichnet sich durch eine höhere Polarität sowie eine geringere Fettlöslichkeit aus, weshalb Methylnaltrexon die Blut-Hirn-Schranke nicht überwindet. Insofern bleibt der analgetische Effekt der Opioide im ZNS bestehen", erklärte Prof. Peter Conzen, München.
Die Wirksamkeit und Sicherheit von Relistor® wurde in zwei doppelblinden, randomisierten Phase-III-Studien , überprüft. In beiden Untersuchungen litten die Patienten unter einer fortgeschrittenen Erkrankung, erhielten eine konstante Opioid-Applikation und hatten entweder in den vorangegangenen 48 Stunden keinen oder weniger als dreimal in der vergangenen Woche Stuhlgang. "Die Ergebnisse der Studie 301 zeigten, dass 62 Prozent der Patienten, die 0,15 mg/kg Methylnaltrexon erhielten, innerhalb von vier Stunden nach der Gabe Stuhlgang hatten. Im Plazebo-Arm waren es nur 13 Prozent", so der Experte.
Schneller und planbarer Wirkeintritt bei guter Verträglichkeit
Auch die Ergebnisse der zweiten Studie, die einen Beobachtungszeitraum von zwei Wochen umfasste, sind viel versprechend. Die Untersuchung wurde noch vor der Zulassung bereits im Mai dieses Jahres im New England Journal of Medicine publiziert. "79 Prozent der Patienten hatten nach mindestens einer der sieben Relistor®-Gaben innerhalb von vier Stunden Stuhlgang", informierte Conzen. "Der Wirkeintritt von MNTX war sehr schnell. Bei der Hälfte der Patienten, die innerhalb von vier Stunden auf den Wirkstoff ansprachen, lag die mittlere Zeit bis zum Stuhlgang bei nur 30 Minuten." Die Unterschiede zwischen den beiden Studienarmen blieben über den gesamten Beobachtungszeitraum bestehen: Mit Relistor® hatten nach jeder der sieben Verabreichungen signifikant mehr Patienten innerhalb von vier Stunden Stuhlgang als mit Plazebo.
Im Anschluss an die doppelblinde Phase konnten sich die Patienten an einer offenen Behandlungsphase mit Relistor® über drei Monate beteiligen. Auch über diese Zeitspanne zeigte sich die gute und langanhaltende Wirksamkeit von Methylnaltrexon. Sowohl bei Patienten, die in der zweiwöchigen doppelblinden Phase dem MNTX-Studienarm zugeordnet waren als auch bei denen, die Plazebo erhalten hatten und erst jetzt Relistor® bekamen.
MNTX wurde in beiden Untersuchungen gut vertragen, wobei flüchtige Bauchkrämpfe und Flatulenz zu den häufigsten Beschwerden gehörten. Die Symptome wurden von den Patienten jeweils als mild oder moderat beschrieben. "Die übrigen Nebenwirkungen lagen auf Plazebo-Niveau und die der Grade 3 und 4 standen in keinem Zusammenhang mit Methylnaltrexon", berichtete der Experte. Während der Behandlung blieb der analgetische Effekt der Opioide im ZNS bestehen. In keiner der beiden Studien zeigten sich signifikante Änderungen im Schmerz-Score (VAS). Zudem traten keine Entzugssymptome oder klinisch relevante Hautirritationen an der Injektionsstelle auf.4 Abschließend wies Conzen auf das Potenzial in weiteren Indikationsgebieten hin. So liegt es nahe, dass auch andere Nebenwirkungen, die durch Bindung der Opioide an periphere Rezeptoren vermittelt werden, mit dem neuen Wirkstoff verbessert werden. Hierzu gehört beispielsweise Harnretention, Juckreiz, Übelkeit und Erbrechen.
OIC -schwerwiegende Nebenwirkung der Schmerztherapie mit Opioiden
Die Opioid-induzierte Obstipation stellt eine der häufigsten Nebenwirkungen einer Opioidtherapie dar. Bis zu 90 Prozent der Patienten, die ein WHO Stufe-III-Opioid zur adäquaten Schmerzbekämpfung erhalten, sind davon betroffen. "Die OIC kann den Erfolg der Schmerztherapie stark gefährden, da viele Patienten die Obstipation als so belastend empfinden, dass sie eher ihre Opioiddosis senken würden als weiter unter der stark einschränkenden Obstipation leiden zu müssen", sagte Dr. Reinhard Sittl, Erlangen zu Beginn seines Vortrags. "Ein besonderes Problem der OIC ist, dass sich im Vergleich zu anderen Nebenwirkungen der Opioidtherapie, wie beispielsweise Übelkeit und Erbrechen, keine Toleranz entwickelt", so Sittl weiter. Bislang erhalten die Patienten zur Milderung der Beschwerden Laxanzien, die jedoch bei nur 52 Prozent der Betroffenen die Obstipation hinreichend verbessern. Zudem wirken Laxanzien nur unspezifisch und symptomorientiert. Darüber hinaus haben einige Präparate eine lange Wirkeintrittsdauer von initial bis zu 72 Stunden. Nebenwirkungen der Laxanzien, zu denen unter anderem unkontrollierter Stuhlabgang und Inkontinenz gehören, belasten die Lebensqualität der Patienten enorm und erschweren auch die Aufgabe des Pflegepersonals.
Insofern ist es sehr bedeutsam, dass nun mit Relistor® ein Präparat verfügbar ist, das eine schnelle und planbare Lösung der OIC bewirkt bei gleichzeitig guter Verträglichkeit mit Nebenwirkungen auf Plazebo-Niveau. Dies kann die Lebensqualität vieler obstipierter Patienten enorm verbessern.